荧光定量PCR(Real-time PCR),是指在 PCR 扩增反应体系中加入荧光基团,通过对扩增反应中每一个循环产物荧光信号的实时检测,最后通过标准曲线对未知模板进行定量分析的方法。
作为上个世纪最伟大的分子生物检测技术,聚合酶链式反应(PCR)技术的出现帮助研究者解决了DNA/RNA模板不足的问题,并通过凝胶电泳的方式对终产物进行定性分析,随着应用的不断扩展,为了解决对初始模板定量的问题,如医院中检测病人血液中乙肝病毒的含量,研究者将荧光颜料加入PCR的反应体系中,并利用染料荧光值变化与DNA双链数量之间的关系,最终计算得出初始模板的数量。这就是我们今天要介绍的实时荧光定量PCR(qPCR)技术。因为qPCR的定量需要依赖由已知浓度标准品制作的标准曲线,所以qPCR也可以说是一种有参的定量。
从实验原理上讲,qPCR与普通PCR是完全一样的,唯一的区别是qPCR在反应体系中加入了荧光染料,根据染料性质的不同,主要可分为以SYBR Green为代表的染料法,以及以TaqMan水解探针为代表的的探针法。
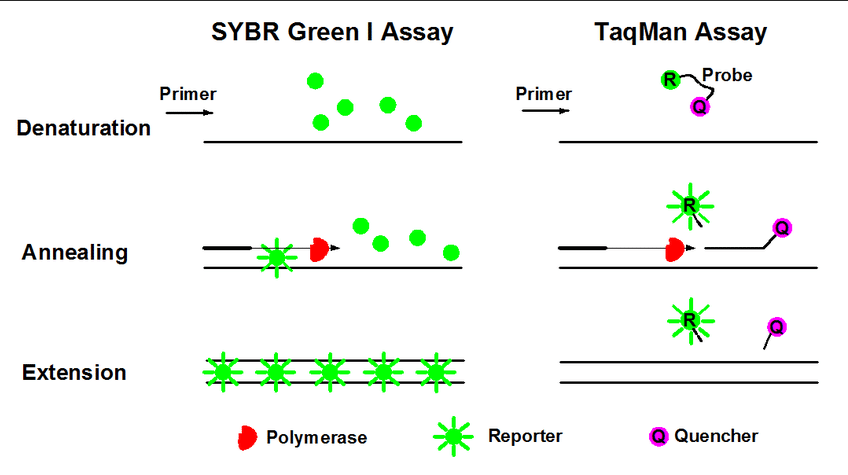
SYBR Green是一种DNA结合染料,能非特异地掺入到双链DNA中去。在游离状态下,它不发出荧光,但一旦结合到双链DNA中以后,便可以发出荧光。在Quantitative Real-time PCR实验中它的最大优点就是可以与任意引物、模板相配合,用于任意反应体系中。从经济角度考虑,它也比其它的探针的Quantitative Real-time PCR价格要便宜得多。但由于它能与所有的双链DNA结合,所以一旦反应体系中出现非特异扩增,那它就会影响到定量结果的可靠性与重复性。要避免这种不利因素,可以通过选择良好的引物并优化反应条件以消除非特异性影响。
探针法则在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。当探针结构完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5'-3'外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。探针法特异性强,被广泛应用在临床的检测项目中(如新冠肺炎检测等)。
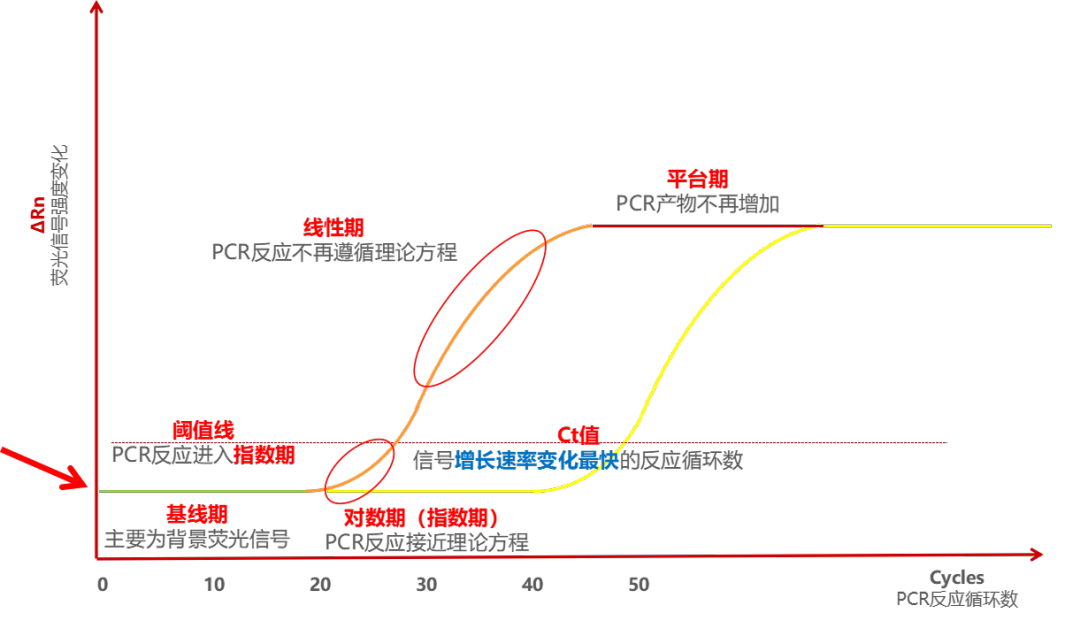
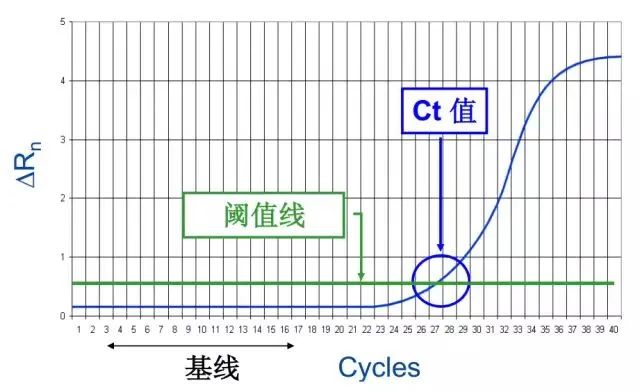
在 PCR 扩增反应的最初数个循环里,荧光信号变化不大,接近一条直线,这样的直线即是基线,这条线是可以自动生成也可以手动设置的。之后反应会进入指数增长期,这个期间扩增曲线具有高度重复性,在该期间,可设定一条荧光阈值线,它可以设定在荧光信号指数扩增阶段任意位置上,但一般会将荧光阈值的缺省设置是3-15个循环的荧光信号的标准偏差的10倍。每个反应管内的荧光信号到达设定的阈值时所经历的循环数被称为CT值,这个值与起始浓度的对数成线性关系,且该值具有重现性。
在您看到荧光定量PCR结果的时候是否也有过这样的疑问?隐隐约约感觉实验某个步骤出现问题,却又不知该从何下手。别担心,让“对照精灵”们来助您一臂之力。
荧光定量PCR实验,从样本采集到结果分析包含多个实验步骤,针对不同的步骤,可以选择不同的对照对流程进行监控。
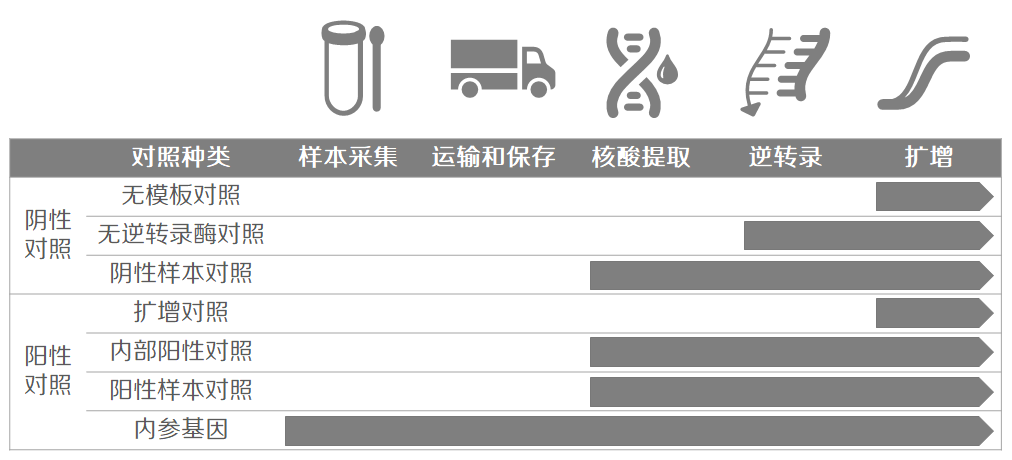
实验流程和常见阴阳性对照种类
荧光定量PCR的灵敏度可以达到1拷贝/孔,如此高灵敏度的检测手段对实验过程中的污染也非常敏感,我们也无法从单一孔中的扩增曲线来判断是否来源于污染还是来源于真实样本的扩增。这时,就需要阴性对照来监控和发现污染的发生。常用的阴性对照包括以下几种:
使用水代替定量PCR反应中的核酸,其它试剂照常加入,用于监控扩增反应体系中的污染。正常情况下,NTC孔不会有扩增;当NTC出现扩增,则预示体系中有污染。在SYBR Green实验中,NTC出现扩增也可能是来源于引物二聚体的形成,此时则需要通过优化引物的设计来减少引物二聚体对结果的影响。
当进行RNA定量实验时,如果引物和探针设计在同一个外显子上,就无法从结果中判断扩增是否来源于未去除干净的DNA,从而影响定量结果的准确性。除了在引物和探针设计上面下功夫,还可以设置无逆转录酶对照。即在逆转录实验时,不加逆转录酶,并进行后续的定量PCR检测。无逆转录对照中由于没有cDNA,DNA聚合酶无法扩增mRNA,则不应发生扩增。如果检测到扩增,则样本中可能含有未去除干净的DNA。
阴性样本指不含有目的基因或者靶序列的样本,也可以是样本保存液。从核酸提取开始做起,经历提取、逆转录(如有)和扩增过程。如果出现扩增,则说明其中某一实验步骤中存在污染,结合NTC结果,可以判断是否是样本提取过程中引入的污染。
可使用含有扩增片段的质粒、假病毒或者基因组DNA/cDNA 作为扩增阳性对照,监控荧光定量PCR的体系是否正常,包括酶、引物、探针等。如果检测中包含多个目标片段,可以将这些目标片段都克隆到同一个质粒中,方便制备和使用。当扩增对照没有扩增,或者Ct值大于预期,则说明定量PCR体系存在问题。
如果想监控每一份样本从核酸提取到逆转录以及最后的荧光定量PCR的过程,可以在提取之前在每个样本中加入一段外源DNA或RNA(不含目的片段),并在定量PCR时进行单管多重PCR,同时检测目的基因和这段序列。在每个样本中加入特定拷贝数的IPC,进而从该段序列的Ct值判断对应样品孔中的核酸富集和扩增效率。也可以选择的逆转录或者扩增的时候加入到每一个样本孔中,单独监测纯化后的核酸中是否含有逆转录/扩增抑制剂。
阳性内对照虽然可以在一定程度上反应核酸提取效率,但是却很难反馈提取流程中对核酸释放的效率。一些病原体的样本,尤其是含有革兰氏阳性菌或者真菌样本,充分的酶消化或者机械裂解对于最终检测的灵敏度有显著影响。为了能更好的反映提取效率,可以选择已知阳性的样本或者保存在相似基质中已知浓度的病原体,作为单独的样本进行提取和后续的RT-PCR,通过Ct值评断实验流程。
上面提到的阳性对照能够为实验流程提供很多质控信息。对于样本本身的质量,比如拭子是否刮取到样本、RNA在运输和保存过程中是否有严重的降解等问题,则可以通过对内参基因的定量来帮助回答。
内参基因一般选择在取样组织或细胞中均有足量表达的基因,且其表达量不受环境、实验处理条件和取样时间等因素影响, 如管家基因(housekeeping gene)。常用人类内参基因如表2所示。要注意没有某个内参基因是万能的,需要根据样本类型和实验处理方式进行评估和选择(可参考Application Note: Using TaqMan Endogenous Control Assays to select an endogenous control)。实验中通过内参基因的Ct值来判断取样和样本降解情况。在相对定量实验中,内参基因亦可用于对取样量进行均一化。
从上文可知没有一种对照是完美的,在检测中我们要根据自己的需求来进行灵活选择和搭配。建议您每一次检测时添加一个能对从提取到扩增环节进行监控的质控品或标准物质;每份检测样品中添加内标(如果样品种类比较多样建议使用人工内标,如果样品类型为相对固定的动物组织建议使用内参基因);扩增阳性对照,扩增阴性对照,无模板对照和 ROX 对照。有条件的添加阳性样本对照和阴性阴性,在怀疑提取环节或者反转录环节出现问题时使用核酸提取对照和反转录对照。不定期使用仪器空白对照。
最后,祝愿您的实验顺顺利利~
END
扫码关注我们:
电话:15234188795
网址:www.junyanbios.cn
邮箱:junyans21@163.com
地址:山西省太原市小店区唐槐路与晋善街交叉口东北角第1号地2期13号楼
区域经理:18701864343/13701962646(上海)
15851483166(江苏、浙江)
15234188795(全国)
技术支持:18536588361、19503412257
邮箱:sales@junyanbios.cn 订购咨询
mkt@junyanbios.cn 商务合作