前言:近日,RichardJude Samulski在Molecular Therapy上刚发表了一篇关于AAV载体的综述,AAV Vectors: The Rubik’s Cube of Human Gene Therapy。从AAV的衣壳、克服抗AAV免疫反应的策略、载体基因组设计、AAV的生产和AAV临床应用5个方面展开阐述。

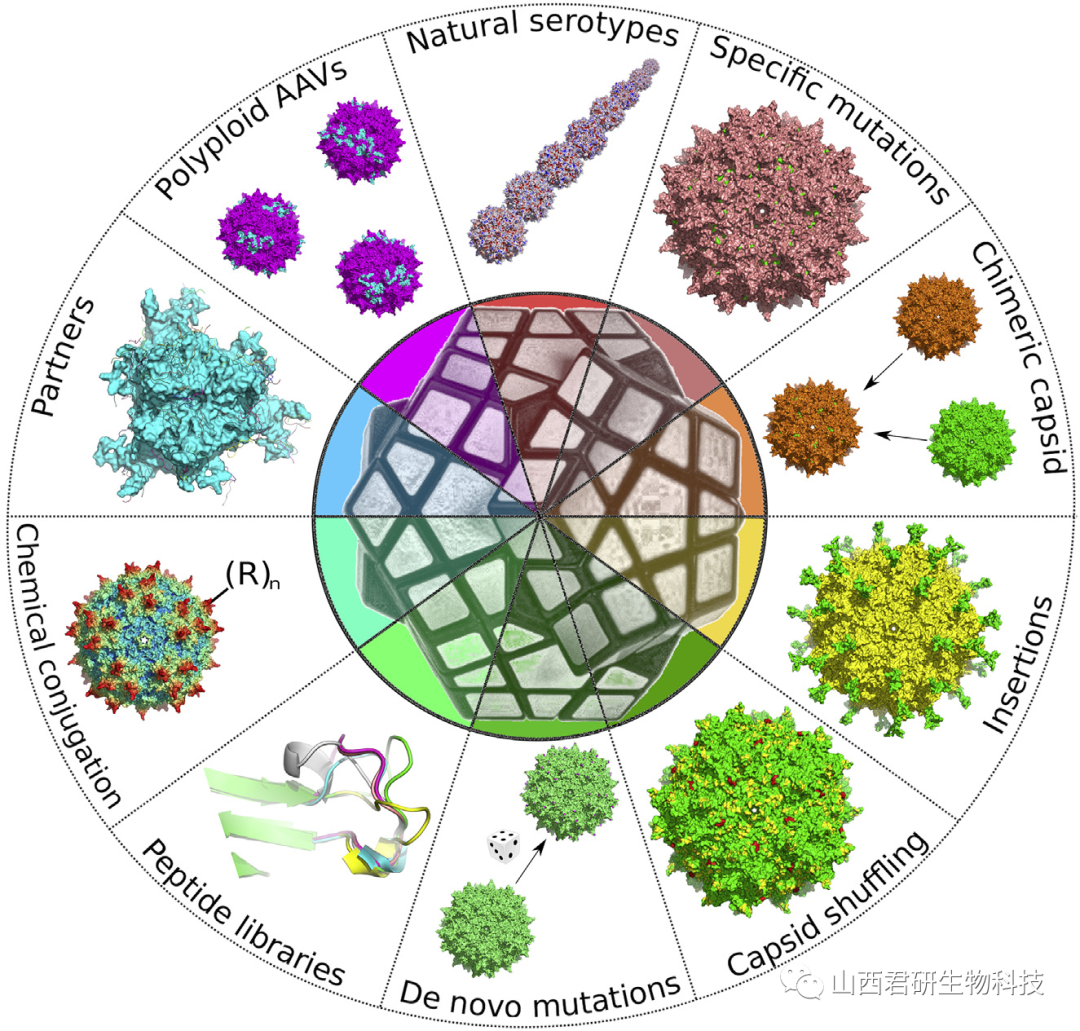
图1. 基于AAV衣壳改变的10种基因递送载体优化方法
如图一所示,接下来展示了基于AAV衣壳改变的10种基因递送载体优化方法。
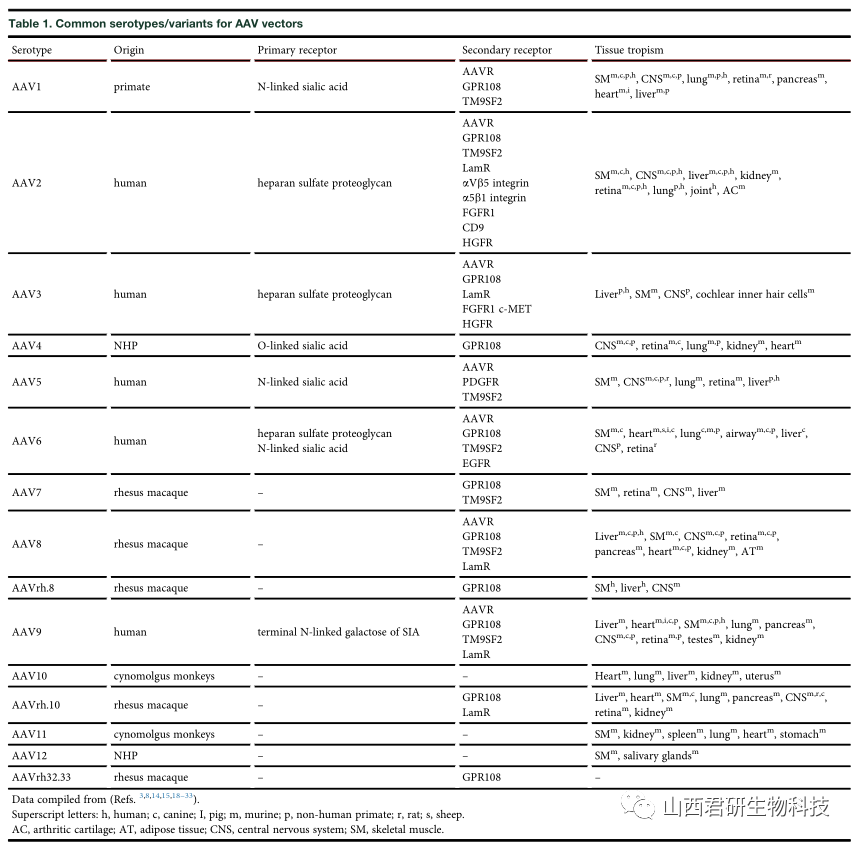
科研人员发现,在293细胞中生产得到的AAV2、AAV3、AAV4、AAV5、AAV6、AAV7、AAV8、AAV9和AAVrh10,有52种翻译后修饰(post-translational modifications, PTMs),其中包括糖基化(36%)、磷酸化(21%)泛素化(17%)、SUMO化(13%)和乙酰化(11%)等。这种翻译后修饰是异质性的,并且在杆状病毒-sf9中和人源-293中生产的AAV翻译后修饰也是不同的。
有4种常用血清型(即AAV2,AAV5,AAV9,和AAVrh10)的衣壳蛋白中有超过7个PTMs,有些修饰是保守的,如N端残基乙酰化,是一种在AAV1、AAV2、AAV3、AAV5、AAV7、AAV9和AAVrh10载体中保守的PTM。AAV载体活性随时间的延长与逐步脱酰胺之间存在相关性,这种脱酰胺现象不是血清型特异性的,有实验证据表明在AAV1、AAV3B、AAV4,AAV5、AAV7、AAV9和AAVrh32.33中均存在这种现象。
目前,已经开发出新的方法,如HILIC-FLR-MS技术和VectorMOD等,用来简化明确血清型鉴定、化学计量学评估、工艺杂质检测和PTMs表征的过程。
AAV嵌合型衣壳改造是通过将一个血清型的功能区块嫁接到另一个血清型上,来改变AAV组织趋向性以及改变感染效率等。例如AAV2i8是一个AAV2/AAV8 的嵌合体,可以高效率选择性地转导心脏和骨骼肌组织,穿越血管,降低肝脏趋向性,并明显改变其抗原谱。
04 多肽和蛋白的插入
不同于衣壳的嵌合,是在特定的VP区域插入一段多肽或蛋白来创造新的AAV衣壳,而不是简单地将功能从一种血清型转移到另一种血清型。这种插入的主要目的是改变自然AAV血清型的组织趋向性。这种改造方法核心是插入什么片段和插入什么位置。
通过在体外对同源基因进行随机重组来实现来自不同血清型的衣壳蛋白重排,创造新的衣壳,并构建衣壳文库,通过经典定向进化的方法,筛选出有特定表型的衣壳。
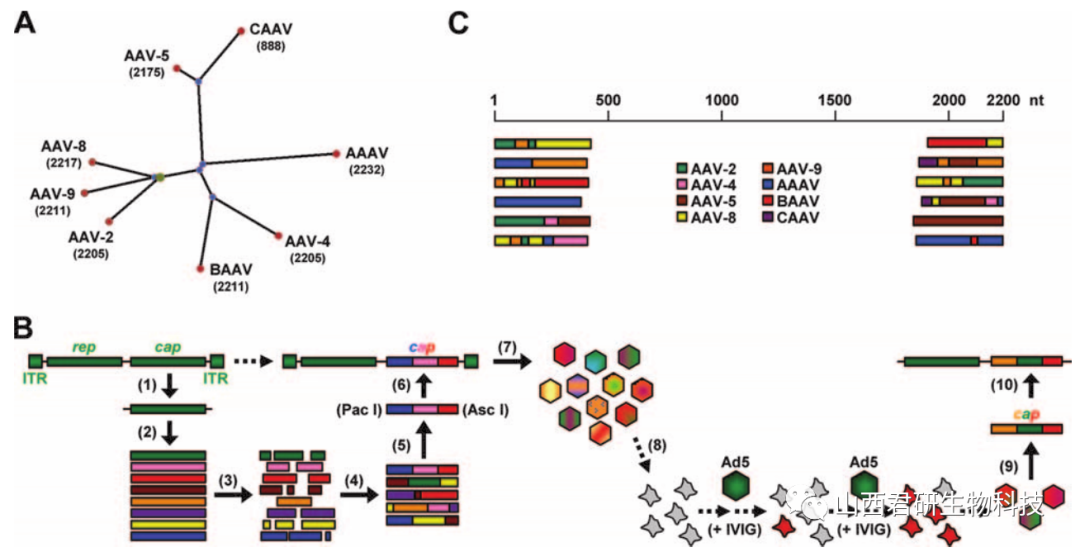
图2. 通过DNA家族重组生成AAV衣壳库
06 衣壳随机突变
另一种获得新衣壳的方法是在衣壳DNA中产生随机突变。突变主要通过修改PCR条件来完成,包括交错延伸和易错PCR。这种方式可以结合衣壳设计和定向干扰,产生的新AAV衣壳性能优于随机变异产生的衣壳。
AAV衣壳的直接进化最常见的方法是将随机肽 (通常为七个氨基酸长) 插入VP环,以生成随机衣壳文库。然而由于直接进化的衣壳蛋白,其受体在不同物种中不替丁是保守的,因此此方法由外转向体内,以及用于人类基因传递都是很大的挑战。
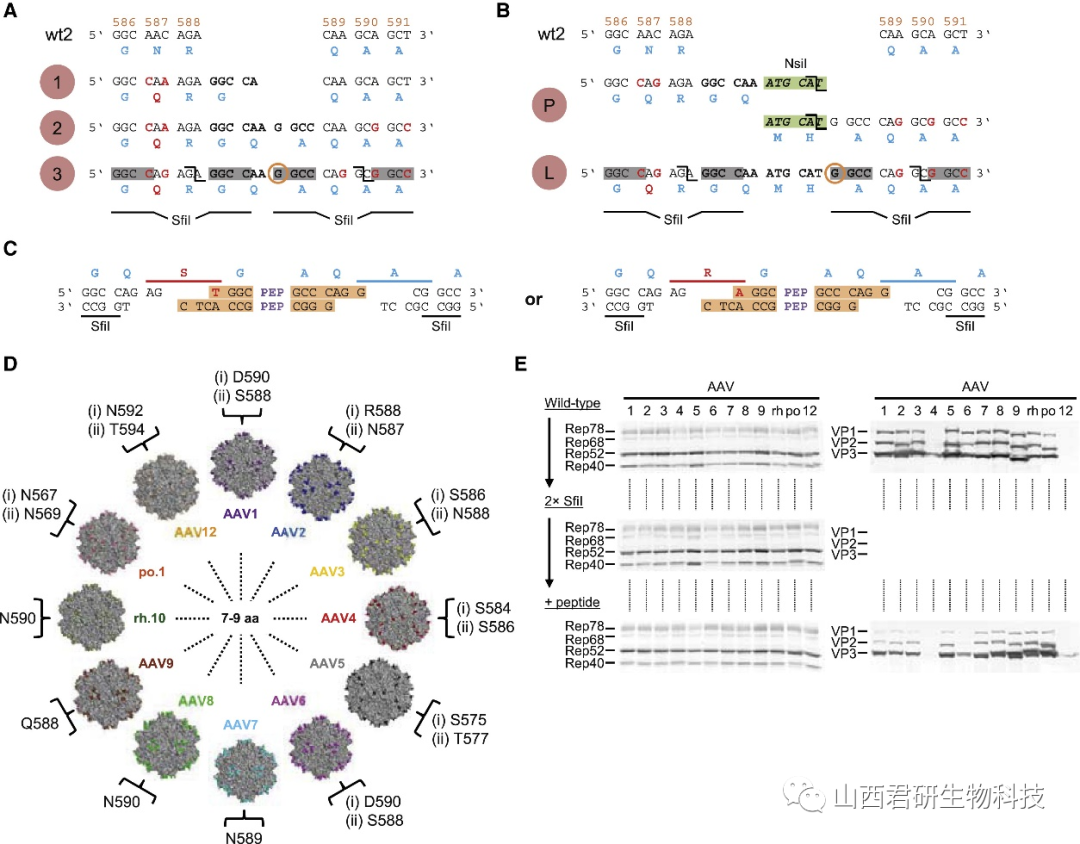
图3. 不同AAV肽库构建
08 其他除了以上几种衣壳蛋白改造策略,文中还提到了化学共轭和非自然的AAV载体、多倍体AAV衣壳和在AAV衣壳上共价连接Partner等手段,共同促进AAV改造技术的进步。
AAV成为基因治疗首选载体的原因之一是其免疫原性相对较低。但是,找到有效的策略来规避可能存在的抗AAV免疫反应,防止机体产生新的免疫反应,对推动基因治疗领域发展来说也是必要的。常用的克服抗AAV免疫反应策略如下:
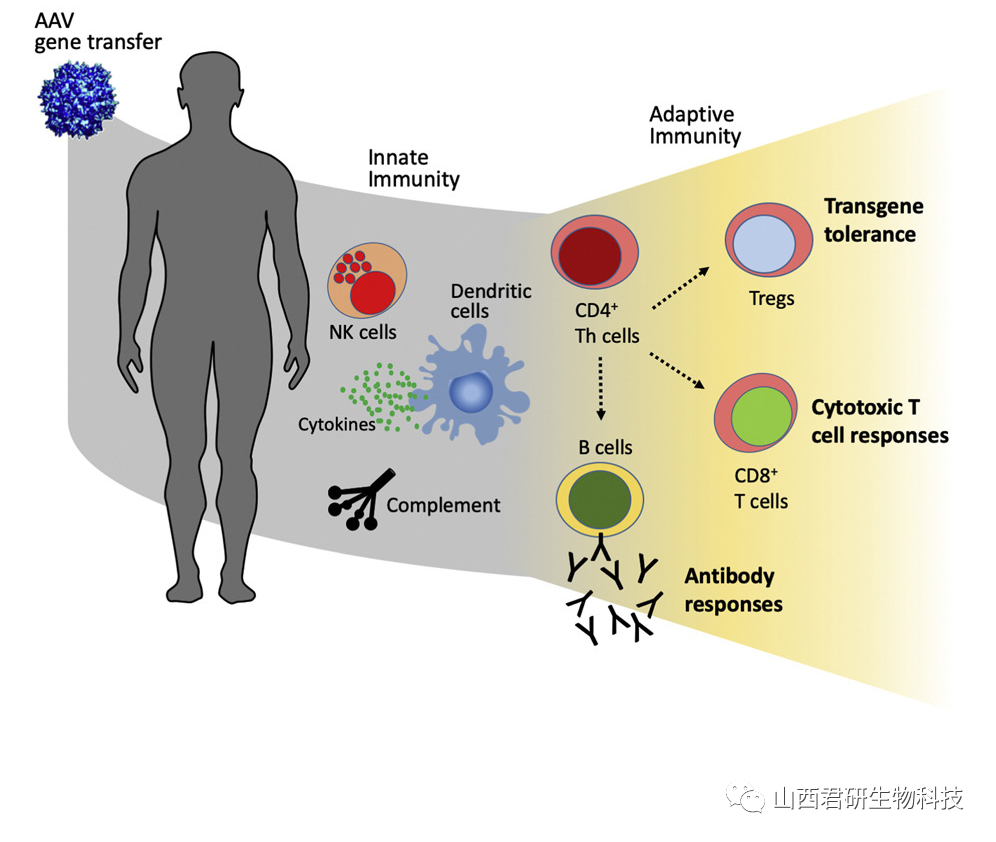
图4. AAV在人体中的先天免疫和获得性免疫过程示意图
测试天然基因启动子的不同缩短序列,获得最小核心启动子
组装已知的增强子和启动子,产生短而强的组成型/组织特异性的启动子
ITR在体外和活体中可改变同一启动子的转基因表达水平
用其他血清型的ITR取代AAV-2末端重复序列也显示出可以改变基因转移效率
考虑根据启动子和靶组织改变ITR序列
加入一些不同长度的内含子序列,并与不同的启动子组合使用
在转基因的3’末端添加加工序列也可以改善转基因的表达
添加S/MAR序列也可以改善转基因表达
poly A改造也会影响基因表达水平
在非翻译区内添加microRNA靶序列可用于抑制某些细胞类型中不希望的转基因表达
增强基因表达
降低转基因免疫原性
合适的密码子优化策略
考虑AAV大小,野生型AAV的基因组大小约为4.7-4.8 kb,而AAV衣壳的包装极限约为5.0- 5.1 kb。
对于单链AAV,载体基因组大小最好调整为理想的4.7±0.1 kb。
4 rAAV的生产方式(PRODUCTION METHODS FOR rAAV)
已经建立的AAV生产方式有:(1)哺乳动物细胞中进行瞬时质粒DNA转染,(2)腺病毒感染稳定的哺乳动物细胞系,(3)重组杆状病毒感染昆虫细胞,(4)重组单纯疱疹病毒 (rHSVs) 感染哺乳动物细胞。
瞬时转染的优点是可以快速生产和测试新的rAAV构建体,以及没有残留的辅助病毒污染。工艺问题是质粒骨架序列也可能被包装进AAV的病毒颗粒中,可能导致先天免疫系统的激活,并导致抗生素抗性基因的传播。改善载体纯度、使用nanoplasmid的系统以及体外合成没有质粒骨架的DNA可以改善这一问题。
另一个常用系统,即重组杆状病毒感染昆虫细胞,由于衣壳蛋白体翻译后修饰与哺乳动物不同,可能带来较差的包装百分比。
重组腺相关病毒载体已用于200多个正在进行的临床研究中,在多种遗传疾病中具有良好的安全性和显著的临床优势。基于其越来越好的临床试验结果,AAV基因疗法已经被证明是一种有效的治疗选择。
2012年,第一种基于AAV1的药物Glybera被欧洲药品管理局 (EMA) 批准,用于治疗脂蛋白脂酶缺乏症治疗,然而,由于对这种治疗的低需求和高成本,该药物最终退出市场。
2017年的Luxturna,是一种用于治疗失明的AAV2载体药物,是美国食品和药物管理局 (FDA)批准的第一种基于病毒的药物。
2019年,Zolgensma,也称为AVXS-101,被FDA批准用于治疗SMA。SMA是由存活运动神经元1
(SMN1)
基因突变引起的,是婴儿死亡的主要遗传疾病之一。15例患者接受了Zolgensma治疗,所有患者在治疗后24个月均存活,无任何事件记录。目前,所有15名儿童都参与了长期跟踪研究,目的是进一步观察他们的发展,再持续15年。
2022年已经又有两款AAV基因治疗药物上市啦,分别是Upstaza和Roctavian。AAV基因治疗虽然还有有待克服的缺陷,但是大家也一直在发掘各种解决问题的方式和手段,对于AAV药物的未来,我们都充满信心。
参考文献
[1] Grimm D , Lee J S , Wang L , et al. In vitro and in vivo gene therapy vector evolution via multispecies interbreeding and retargeting of adeno-associated viruses.[J]. Journal of Virology, 2008, 82(12):5887-5911.
[2]Yasunori, Matsuzaki, Masami, et al. Neurotropic Properties of AAV-PHP.B Are Shared among Diverse Inbred Strains of Mice.[J]. Molecular Therapy the Journal of the American Society of Gene Therapy, 2019.
[3] Ronzitti G , Gross D A , Mingozzi F . Human Immune Responses to Adeno-Associated Virus (AAV) Vectors[J]. Frontiers in Immunology, 2020, 11:670.
【版权声明】本公众号推送文章仅为学术交流使用,‘原创’为原创编译之标记,不表示本平台对文本主张版权。作者团队或单位如需使用编译文本,可联系小助开放白名单。凡是注明“转载”的稿件,均已注明直接来源,如需使用,请联系版权人。如有侵权,请联系我们,我们会尽快删除。
关于君研
君研生物科技(山西)有限公司是由海外归国人才创办的高新科技企业,专注于抗体等原料及生物药质控检测产品的研发,为抗体、基因/细胞治疗、疫苗等药企及研发机构提供国际品质的产品和技术服务。公司汇集了以海归首席科学家、长江学者、行业专家以及优秀硕博士人才为主的专业团队,拥有重组蛋白、抗体、核酸和检测试剂等研发平台,已为超百家药企提供优质稳定的产品。君研生物坚持生物原料中国造,以“专业技术服务人类健康”为理念,以打造中国品牌为己任,坚持持续创新的态度,为客户创造价值,为人类健康贡献力量。
地址:山西省太原市小店区唐槐路与晋善街交叉口东北角第1号地2期13号楼
区域经理:18701864343/13701962646(上海)
15851483166(江苏、浙江)
15234188795(全国)
技术支持:18536588361、19503412257
邮箱:sales@junyanbios.cn 订购咨询
mkt@junyanbios.cn 商务合作