随着新冠疫情的爆发,各类新冠疫苗技术路线开始群雄角逐,包括灭活苗、重组蛋白苗、腺病毒载体苗、核酸苗等,其中灭活苗凭借其在国内长久累积的经验优势,一举成为国内最快获批上市的疫苗产品,也是为数不多可以年产10亿剂以上的新冠疫苗产品。而传统的灭活苗生产,一般借助于Vero细胞的培养,可以这么说,Vero细胞在疫苗行业的地位,正如同CHO细胞在抗体领域的地位一样,不可撼动。
Vero细胞(非洲绿猴肾细胞)是日本学者Yasumura和Kawakita两人在1962年正式从非洲绿猴肾脏分离的,初次用于生产人用生物制品的异倍体贴附依赖性细胞,并建立了细胞系和不同代次的细胞库。在此之前,对生物制品的研究和生产只允许用原代细胞或二倍体细胞。
近年来随着生物技术的发展,动物细胞培养技术已从简单的试验研究拓展到了生物学研究和商业应用领域。生物制品如病毒性疫苗、医学治疗性抗体的研究与生产都用到了细胞培养技术。
1987年,WHO才正式批准传代细胞系作为生物制品生产的基质。Vero细胞被批准用于人用疫苗的生产后,开始生产的人用疫苗是Barrett等生产的脊髓灰质炎灭活疫苗(IPV),之后Vero细胞用于狂犬病毒疫苗和口服脊髓灰质炎病毒疫苗(OPV)等多种人用疫苗生产。Vero细胞在病毒性疫苗生产的应用已有30年之久,尤其是狂犬病毒疫苗和脊髓灰质炎疫苗。

容易建立细胞库和保存,可连续传代,生长速度快;
Vero 细胞遗传性状稳定,恶性化概率小,无外源性污染,具有良好的生物安全特性;
Vero 细胞对多种病毒敏感,生产的病毒滴度高;
Vero 细胞对培养条件要求不高,在微载体表面能良好的贴附生长,易在生物反应器放大培养。
04 宿主DNA片段检测 Detection of host DNA fragments

这是国内的指导原则首次将风险性 DNA 残留片段的大小控制在 200bp 以下进行明文规定,其实早在 2010 年 FDA 发布的生物制品相关指导中,就有强调根据不同细胞系来源和遗传背景需要,可通过降低残留 DNA 的含量、减小残留 DNA 片段的大小(如 DNase 或其他办法处理)至功能基因大小以下,在终产品中需要检测残留 DNA 的含量和片段大小分布情况。现有研究表明,一个功能基因至少在 200bp 以上,因此,为减少残留 DNA 风险,FDA 建议残留 DNA 片段不大于 200bp。DNA 片段大小风险等级如下表:
DNA 片段大小风险等级划分
|
宿主细胞残留 DNA 片段 bp |
风险因子 |
|
<200 |
1 |
|
200-1000 |
2 |
|
>1000 |
3 |
|
>2000 |
4 |
注:风险依风险因子数值递增
vero细胞系是病毒类疫苗生产常用一种永生细胞系,宿主细胞的残留的DNA存在感染性、免疫原性或致癌性等。对于残留DNA的最大可承受量为10ng/剂,而对于DNA大小片段的要求则为小于一个功能基因的长度,一个功能基因最小长度为200bp,大于200bp以上的片段其潜在风险较大,测试在成品中的残留DNA片段大小的分布情况对于疫苗生产企业十分必要。
君研生物自主研发的Vero残留DNA片段(qPCR)检测试剂盒可用于定量检测各种生物制品的中间品、半成品和成品中Vero宿主细胞DNA残留片段大小分布,利用PCR荧光探针法原理设计了四种不同的扩增片段(86bp、154bp、242bp、540bp),快速、特异地检测DNA片段的分布情况。该试剂盒可配套我公司宿主残留DNA样本前处理试剂盒使用。
线性标准:依据国家对此类标准曲线方法建立的基本要求,各项指标全,标准高
精密度高:低浓度重复性CV值<20%;中高浓度重复性CV值<15%
即用便捷:使用试剂盒中即用型标品,操作便捷,批内差小
稳定性高:受环境影响小,保质期内性能稳定
数据结果:
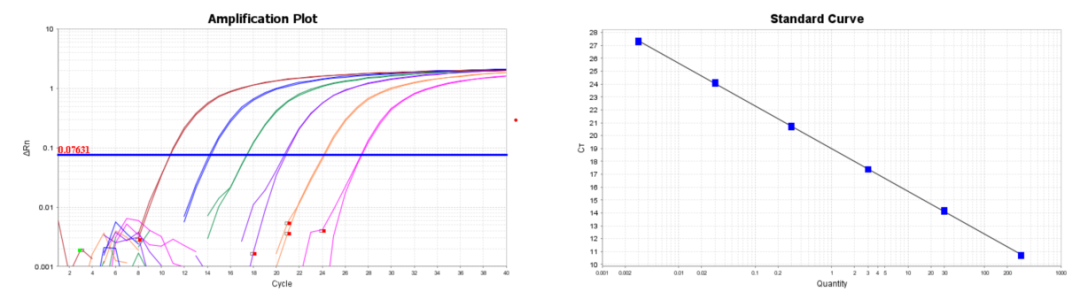
86bp和154bp残留DNA(qPCR)检测试剂盒标准曲线
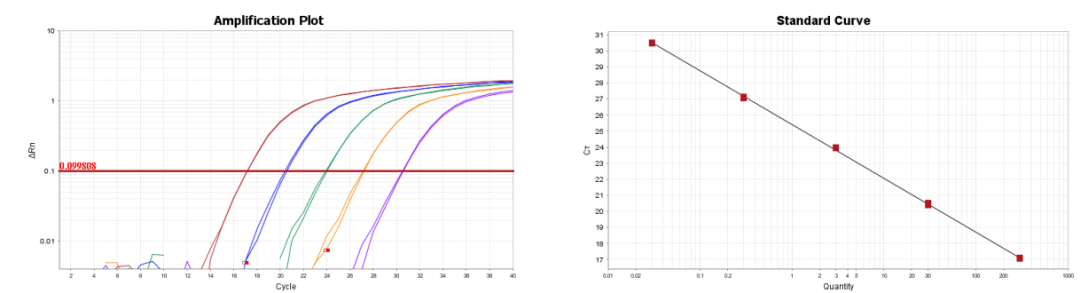
242bp和540bp残留DNA(qPCR)检测试剂盒标准曲线
03地址:山西省太原市小店区唐槐路与晋善街交叉口东北角第1号地2期13号楼
区域经理:18701864343/13701962646(上海)
15851483166(江苏、浙江)
15234188795(全国)
技术支持:18536588361、19503412257
邮箱:sales@junyanbios.cn 订购咨询
mkt@junyanbios.cn 商务合作