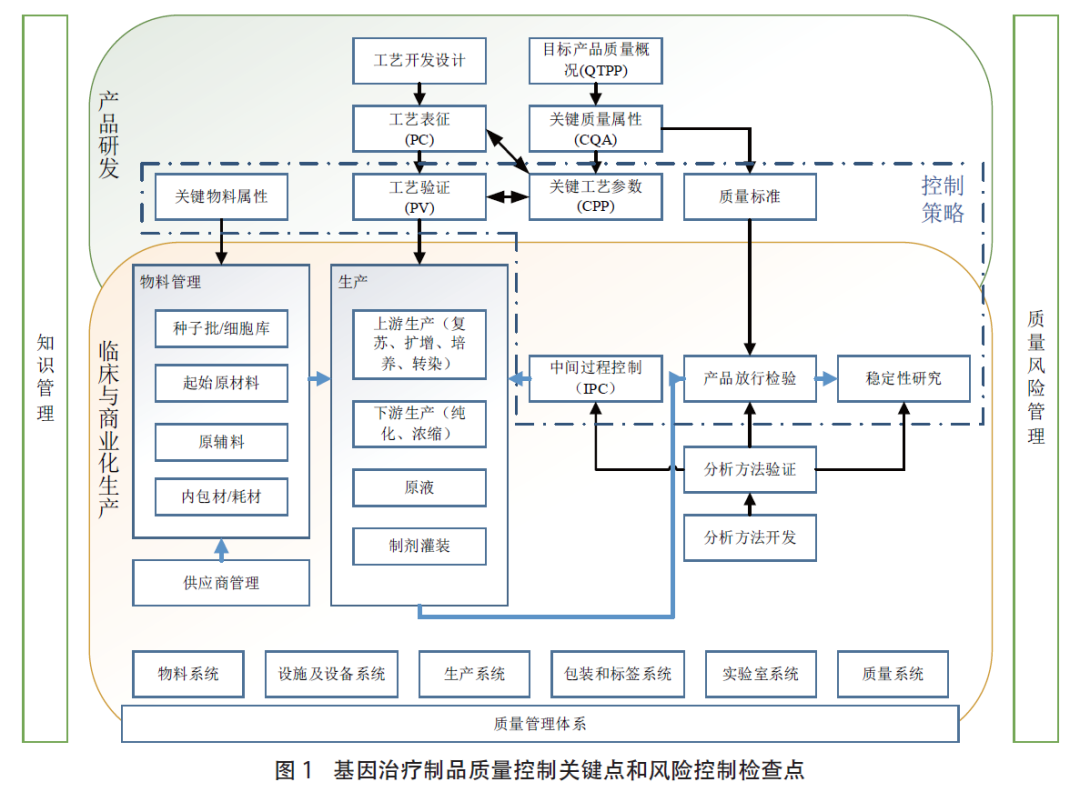
随着越来越多的基因治疗制品进入临床或上市,逐渐暴露出潜在的安全性风险,其中病毒安全性、基因毒性(致瘤性)和免疫毒性受到广泛关注。同时,基因治疗制品的质量控制也面临诸多挑战,如生产工艺存在局限性;在质量研究方面,结构表征及其他特性分析还不够深入,例如衣壳蛋白的修饰、基因组结构的完整性、载体靶向性和整合特性等;在质量标准方面,检测项目及标准限度还不完善,甚至很多项目缺少有效的检测方法。因此,各国监管部门都在加速制定相关法规、技术指南和技术规范,用于指导基因治疗制品的研发和评价。
为配合相关法规和指南的出台和落实,完善和细化基因治疗制品质量控制技术规范,中国食品药品检定研究院联合基因治疗业界相关专家,历时两年,参考大量国内外指南和规范,调研了国内相关单位的实际质量控制现状,组织编写了《基因治疗制品质量控制概述》(简称《质控概述》),包括基因治疗制品原辅料及质量控制、病毒载体及质粒载体的制备及质量控制、细胞基质的制备及质量控制、基因治疗制品生产过程中的质量控制、基因治疗制品的质量研究及质量控制以及基因治疗制品的稳定性研究。

《中国药事》2023年6月第6期
共设5个栏目,1个专栏,刊载论文13篇
本《质控概述》目的是为基因治疗制品从业者科学、合理、合规地开展工艺开发,规范、有序地生产和严谨地质量控制提供指导性建议,主要针对产品申报上市阶段,为未来规模化和产业化打下基础。产品临床阶段可根据各阶段的研发特点和研究目的,参考本概述开展与阶段相适应的研究。同时,以易懂的方式为从业者提供必要的质量控制基本原则。其适用范围主要为基因治疗制品,活性成分包括质粒载体、病毒载体和细菌载体等,其中以病毒载体为重点,如腺相关病毒载体、腺病毒载体、单纯疱疹病毒载体等,也可用于其他适用的病毒类生物制品。
▲图片来源:中国药事
* 文章内容来源于中国药事,转载文章仅供分享,如有涉及版权问题,请及时与我们联系:19503412257(微信同号),我们将给予删除或下线处理。

地址:山西省太原市小店区唐槐路与晋善街交叉口东北角第1号地2期13号楼
区域经理:18701864343/13701962646(上海)
15851483166(江苏、浙江)
15234188795(全国)
技术支持:18536588361、19503412257
邮箱:sales@junyanbios.cn 订购咨询
mkt@junyanbios.cn 商务合作